| Introduction au métabolisme |
| Toute cellule est le siège de milliers de réactions chimiques qui mettent en jeu des transferts de matière et/ou d'énergie. Cet ensemble de réactions biochimiques s'appelle le métabolisme. Les réactions forment un réseau de voies métaboliques le long desquelles les molécules, que l'on appelle des métabolites, sont transformées. |
| Le schéma ci-contre illustre l'interdépendance des voies métaboliques. Chaque point est un métabolite : une molécule biologique synthétisée lors d'une réaction biochimique précise. Les traits qui relient les points sont les réactions biochimiques. Chaque métabolite est issu d'un (ou plusieurs) précurseur(s) et est le précurseur d'un (ou plusieurs) métabolite(s). |
| Bien que la plupart des cellules (organismes) possède le même ensemble de voies métaboliques de base (exemple typique : la glycolyse), les cellules (organismes) peuvent se distinguerpar des voies métaboliques qui leur sont propres. Cette spécialisation est liée aux sources d'énergie, aux sources de carbone et à la compartimentation sub-cellulaire. La classification basée sur les sources d'énergie définit 2 groupes majeurs d'organsimes :
|
| Pour vivre, la cellule doit puiser de l'énergie du milieu extérieur. Il s'agit, par exemple, de l'énergie lumineuse dans le cas de la cellule végétale.Cette énergie initiale sert à la photosynthèse, au cours de laquelle le CO2 et l'eau se combinent (réaction de réduction) pour former des glucides. Puis, chez les organismes aérobies, ces glucides sont oxydés pour reformer de l'eau et du CO2 au cours de la respiration. 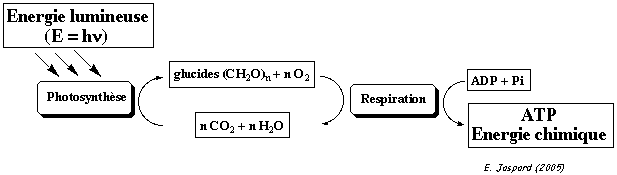 |
De tels processus (photosynthèse et respiration) transforment :
| 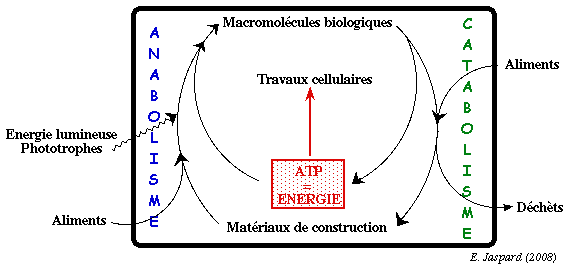 |
Anabolisme
matériaux de construction + ATP ---> macromolécules complexes |
Catabolisme
macromolécules complexes ---> matériaux de construction + ATP | |
Ensemble des voies métaboliques qui :
| Ensemble des voies métaboliques qui :
| |
Exemples :
| Exemples (figure ci-dessous) :
|
Au cours des processus cataboliques, la partie utile de l'énergie initiale (l'énergie libre de Gibbs) est stockée dans des intermédiaires particuliers qui sont deux coenzymes réduits porteurs d'électrons :
| 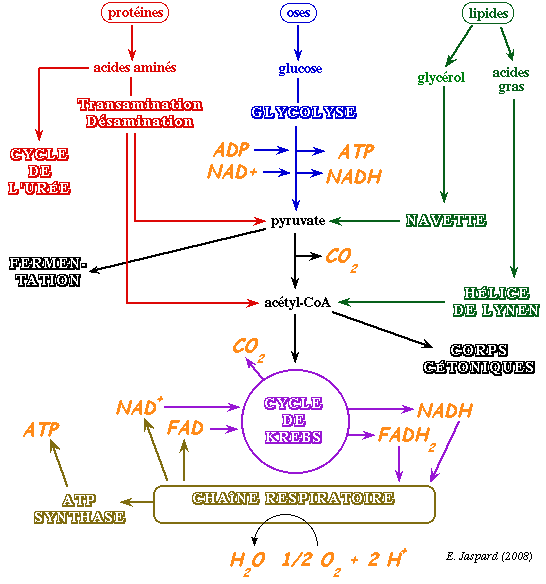 |
| L'anabolisme et le catabolisme ont lieu simultanément dans la cellule : ces deux processus sont extrêmement régulés de manière coordonnée.Par ailleurs, les voies de biosynthèse et de dégradation qui pourraient être en compétition sont, chez les Eucaryotes, souvent localisées dans des compartiments sub-cellulaires distincts. Exemple : la voie de dégradation oxydative des acides gras est localisée dans la mitochondrie et celle de leur biosynthèse est localisée dans le cytosol. Toutes les réactions du métabolisme se déroulent à une très grande vitesse, bien supérieure à celles qu'elles auraient isolément dans la nature, grâce à des catalyseurs biologiques : lesenzymes. |
La variation d'énergie libre de Gibbs
La variation d'énergie libre de Gibbs, ΔG', mesure la partie de l'énergie d'un système qui produit un travail utile.
La variation d'énergie libre de Gibbs standard est désignée par ΔG°'. |
Variation d'énergie libre de Gibbs et constante d'équilibre
Pour une réaction quelconque : A + B <===> C + D[C]φ . [D]φ ΔG'réaction = ΔG°'réaction + RT Ln ( --------------------- ) [A]φ . [B]φ Equivalent à : ΔG'réaction = ΔG°'réaction + RT Ln (rapport des concentrations dans la cellule) A l'équilibre, ΔG' = 0 : [C]éq . [D]éq Alors : ΔG°'réaction = - RT Ln ( ----------------------- ) = - RT Ln Kéq [A]éq . [B]éq
|
Couplage des réactions biochimiques
L'énergie libre de Gibbs libérée par une réaction dont ΔG' est très négative peut-être utilisée pour qu'une réaction dont ΔG' est positive se déroule.On parle alors de couplage des réactions.
|
Rôle et structure de l'ATP
L'ATP joue donc un rôle central dans le métabolisme cellulaire :
|
L'ATP est un triphosphate de nucléoside dans lequel :
| 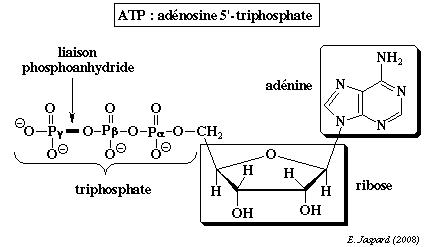 |
| Figure ci-dessous : mécanisme catalytique (simplifié) du transfert du groupement phosphoryle de l'ATP par les protéines kinases. L'état de transition est au milieu. Le produit est une tyrosine ou une serine/threonine phosphorylée de la protéine cible. 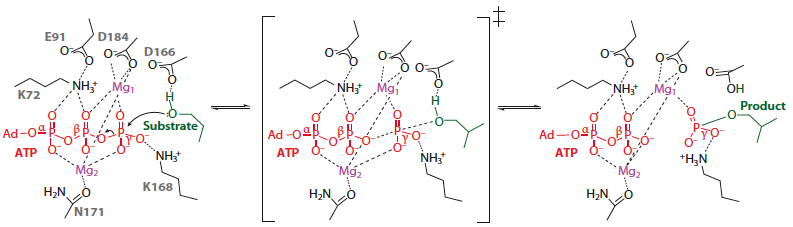
Source : Endicott et al. (2012)
|
Visualisation de l'ATP au sein de la "RNA editing ligase 1" ("editosome") à une résolution de 1,20 Å.
Code PDB : 1XDNPour faire apparaître de multiples fonctions du menu Jmol :
|
L'énergie libre de Gibbs contenue dans la structure de l'ATP est transférée au moment où la liaison ester phosphate ou les liaisons phosphoanhydrides sont hydrolysées.
|
| Exemples d'autres composés à haut potentiel énergétique | ||
| molécule | type de liaison | ΔG°' hydrolyse |
| phosphoénolpyruvate | énol ester | - 14,8 kcal/mol |
| acétyl phosphate | anhydride mixte | - 11,2 kcal/mol |
| phosphocréatine / phosphoarginine | phosphoamide | - 10,3 kcal/mol |
| coenzyme A ou CoASH | thioester | - 9 kcal/mol |
| pyrophosphate inorganique (PPi) | phosphoanhydride | - 8,0 kcal/mol |
| adénosine diphosphate (ADP) | phosphoanhydride | - 7,3 kcal/mol |
| adénosine monophosphate (AMP) | ester phosphate | - 3,5 kcal/mol |
| Le pouvoir réducteur des coenzymes |
| 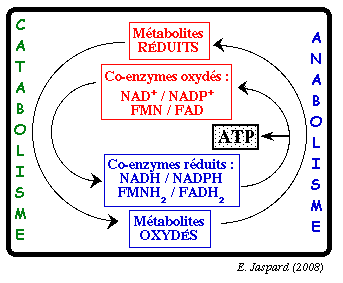 |
| Ces molécules constituent une forme d'énergie universelle. Leur énergie chimique est contenue dans les électrons qu'elles portent à l'état réduit. Cette énergie est libérée lors de leur réoxydation et elle sert à la formation d'un gradient de protons (force proton motrice) utilisé pour la synthèse d'ATP . |
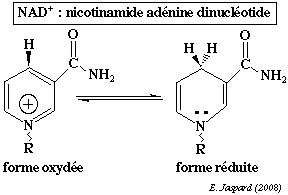
| La nicotinamide adénine dinucléotide contient la nicotinamide qui est l'amide de l'acide nicotinique. A cours de la réduction du coenzyme, le groupe nicotinamide capte un proton et un ion hydrure H+ d'un substrat qui est déshydrogéné :
NAD+ + 2H+ +2 e- <===> NADH + H+
 | 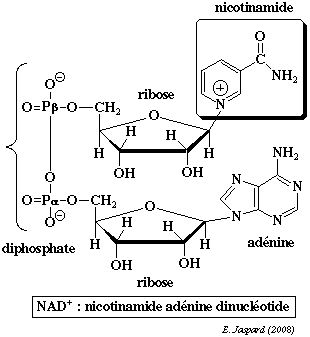 |
| Dans la structure de la nicotinamide adénine dinucléotide phosphate (réduite ou non / NADP+ ou NADPH+), un groupe phosphoryle supplémentaire substitue l'hydrogène de l'hydroxyle situé en position 2' du ribose lié à l'adénine. | 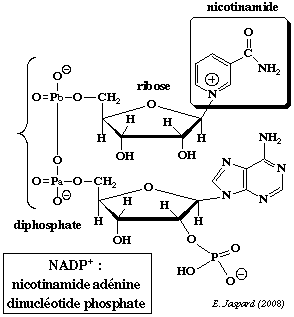 |
Quelques éléments de la régulation du métabolisme
Voir un ensemble de cours sur la régulation du métabolisme.L'environnement des organismes et des cellules change en permanence. Les réactions du métabolisme doivent donc être finement régulées pour :
|
1. Les réactions irréversibles du point de vue énergétique.
Réactions réversibles :
|
2. La quantité d'enzymes synthétisées
Les enzymes catalysent les réactions biochimiques : le contrôle de la quantité d'enzymes synthétisées est donc un autre moyen de régulation du métabolisme.Ce contrôle s'exerce de diverses manières.
a. Le niveau de transcription des gènes
Par exemple, au cours de la répression catabolique de l'opéron lactose chez les bactéries, quand la concentration en glucose diminue, le métabolisme du lactose devient nécessaire.Le signal de carence alimentaire est une augmentation de la concentration de l'AMP cyclique (AMPc). L'AMPc se fixe à la protéine "CAP" ("Catabolite gene Activator Protein"). Ce complexe se lie à l'ADN et augmente l'affinité de l'ARN polymérase pour le promoteur de l'opéron, ce qui se traduit par une augmentation d'un facteur 50 de la transcription de l'opéron lactose. Voir un cours sur les EST ("Expressed Sequence Tags") et la transcriptomique. |
b. La modulation de l'activité et de la localisation des facteurs de transcription
La phosphorylation et la déphosphorylation modulent l'activité de certains facteurs de transcription, soit en lesactivant directement, soit en modifiant leur localisation cellulaire.Exemple : les MAP kinases ("Mitogen-activated protein kinases") sont impliquées dans des voies de signalisation en réponse à des signaux extracellulaires (facteurs de croissance, cytokines, ultraviolets, agents de stress, ... -figure ci-contre). Elles régulent un grand nombre d'activités cellulaires, en particulier l'expression des gènes. En effet, ce sont des sérine/threonine protéines kinases qui phosphorylent certains facteurs de transcription, modifiant ainsi l'activité de ces molécules. | 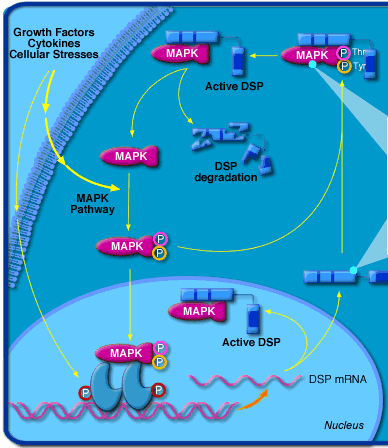
Source : Biocarta
|
c. La régulation post-transcriptionnelle
|
Une étude des transcrits de 10 chromosomes humains a montré que prés de la moitié sont non polyadénylés [poly(A)-] (Cheng et al., 2005) :
| 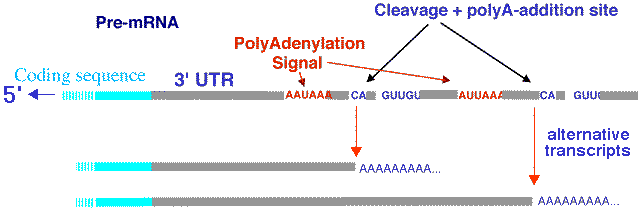
Source : D. Gautheret - INSERM ERM206
|
| La polyadénylation chez les procaryotes : voir Sarkar (1997) "Polyadenylation of mRNA in prokaryotes" Annual Rev. Biochem. 66, 173-197 |
| d. La régulation traductionnelle Elle régule la quantité d'ARN messagers traduits en protéines ou enzymes. C'est l'interférence ARN (siRNA, miRNA, ...). |
3. L'activité des enzymes
La vitesse de catalyse de chacune des réactions du métabolisme et donc le flux global des voies métaboliques dépendent de l'activité des enzymes.Il existe différents mode de régulation de l'activité des enzymes :
|
4. Les signaux extracellulaires
Les signaux extrinsèques jouent un rôle capital dans la régulation du métabolisme.Les signaux extracellulaires émanent :
Parmi les messagers secondaires, on peut citer : l'AMP cyclique, le calcium, la calmoduline, les phosphatidylinositols, le diacylglycérol, ... Dans la grande majorité des cas, cette cascade d'évènements de signalisation met en jeu des protéines kinases qui phosphorylent des enzymes. Cette modification post-traductionnelle induit une modification de la structure de ces enzymes qui se traduit par une diminution ou une augmentation de leur activité. En conséquence, le flux des voies métaboliques est modifié. |
| Liens Internet et références bibliographiques |
| Vision globale du métabolisme (Expasy) - (Figure interactive) | Aller au site |
| "Biocarta" : site interactif sur la signalisation cellulaire | Aller au site |
| "The UCSD-Nature Signaling Gateway" - A comprehensive resource for information about cell signaling. | Aller au site |
| KEGG PATHWAY Database | Aller au site |
| "MetaCyc" : database of nonredundant, experimentally elucidated metabolic pathways (more than 1,100 pathways from more than 1,500 different organisms). | Aller au site |
| Cheng et al. (2005) "Transcriptional maps of 10 human chromosomes at 5-nucleotide resolution" Science 308, 1149 - 1154 Endicott et al. (2012) "The Structural Basis for Control of Eukaryotic Protein Kinases" Annu. Rev. Biochem. 81, 587 - 613 | Article Article |
0 comments:
Post a Comment